Metalle
Zink
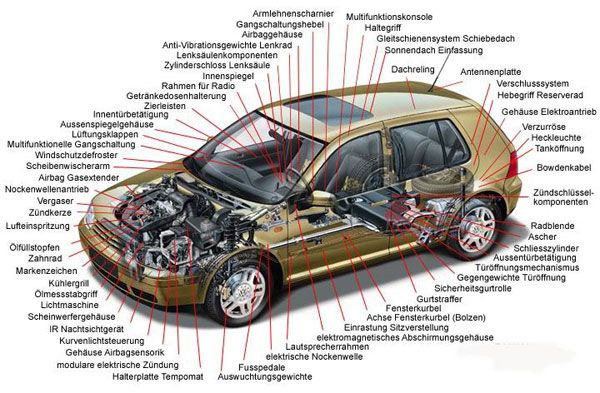
Zink gehört mit einer Dichte von 7,13 g/cm3 zu den Schwermetallen und spielt als Spurenelement eine wichtige Rolle im menschlichen Körper, z. B. als Bestandteil vieler Enzyme. Ein Auto enthält heute ungefähr 10 kg Zink, etwa 3 kg davon dienen als Korrosionsschutz. Insgesamt kommt dieses Metall in fast hundert Autoteilen vor. Hier einige Beispiele:

Es ist ein sehr unedles Metall, Zinküberzüge schützen daher Eisen einerseits als „Opferanode“, indem sie schneller in Lösung gehen als das etwas edlere Eisen, andererseits bildet Zink eine Oxid-, bzw. Hydroxidschicht aus (siehe Kapitel Eisen und Aluminium), die es vor Korrosion schützt. 2007 wurden 36 % des in Deutschland verarbeiteten Zinks für die Stahlverzinkung verwendet.

Verfahrensablauf des Stückverzinkens
(schematisch: Verfahrensvarianten sind möglich)
Viele kleine Teile im und am Auto sind im Druckgussverfahren hergestellt, wie dieser Türgriff.
Reines Zink eignet sich nicht zum Gießen, deshalb erzeugt man Zinklegierungen, die meist bis zu 4 % Aluminium und noch wesentlich geringere Mengen Kupfer enthalten, die aber eine hohe Festigkeit und sehr gute Gießfähigkeit aufweisen.

Die flüssige Legierung wird unter hohem Druck in die Form gepresst und erkaltet sehr schnell. Der Vorgang dauert nur wenige Sekunden, so dass mit geringem Zeitaufwand hohe Stückzahlen hergestellt werden können. Durch Veredelung der Oberfläche, z. B. durch Lacke, können sehr ansprechende Effekte erzielt werden.
Zink hat außerdem im Reifengummi eine sehr wichtige Funktion: Zwar klingt die Menge mit ca. 500 g je PKM nicht viel, aber sie ist dafür sicherheitsrelevant. Bei schwefelvernetzten Vulkanisaten startet das Zinkoxid zusammen mit den organischen Vulkanisationsbeschleunigern die Vernetzungsreaktion zwischen dem Kautschuk und dem Schwefel (Netzwerkbildung). Dies geht in vernünftigen Zeiträumen nur im Zusammenwirken von ZnO und Beschleuniger. Nach Abschluss der Vulkanisationsreaktion trägt ZnO dazu bei, die Wärmebildung bei dynamisch beanspruchten Gummiteilen gleichmäßig im Gummiteil zu verteilen. Es puffert saure Abbauprodukte, die bei der Alterung von Gummi entstehen, wirkt also als „Alterungsschutzmittel“. Zink gibt dem Reifen Alterungsbeständigkeit und hilft partielle Überhitzungen zu vermeiden.
Gewinnung von Zink
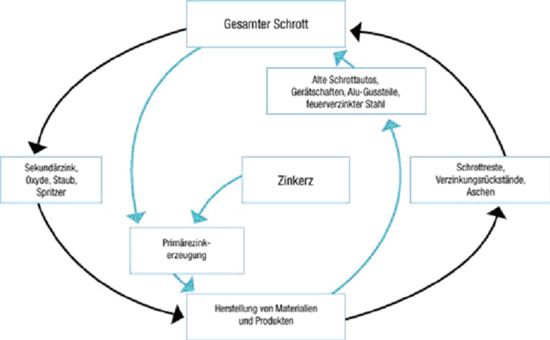
Die Gewinnung von Zink erfolgt aus den mineralischen Vorkommen. Das häufigste Zinkmineral ist Zinksulfid (Zinkblende). Hauptförderland ist heute China, an zweiter Stelle steht Australien. Die deutschen Lagerstätten im Aachener Raum, im Sauerland und im Harz sind erschöpft. Über 30 % des Zinkbedarfs wird aus recyceltem Zinkschrott gedeckt.
Die chemischen Vorgänge bei der Zinkgewinnung:
Dabei wird das Schwefelsulfid unter Luftzufuhr auf über 900 °C erhitzt:
ZnS + 11/2 O2→ ZnO + SO2
Das Schwefeldioxidgas wird ständig abgesaugt und im Kontaktverfahren zu Schwefelsäure weiterverarbeitet.
Im Imperial Smelting Verfahren werden in einem Gebläseschachtofen das Zinkoxid und die noch vorhandenen Begleitstoffe, besonders Blei, Eisen und Silber, mit Kohlenstaub gemischt und bei 1.000 bis 2.000 °C geschmolzen. Es entsteht Kohlenstoffmonooxid, das die Metalloxide reduziert:
ZnO + C → Zn + CO
ZnO + CO → Zn + CO2
Das Kohlenstoffdioxid reagiert mit der Kohle zu weiterem Kohlenstoffmonooxid:
CO2 + C → 2 CO
Das Blei mit seinem Schmelzpunkt von 328 °C und seinem Siedepunkt von 1.740 °C fließt in flüssigem Zustand ab, Zink entweicht als Gas, da es einen Siedepunkt von
906 °C hat, Eisen verbleibt in der Schlacke, die im Straßenbau Verwendung findet.
Bei diesem heute weit überwiegend angewandten Verfahren wird das Röstgut in der „Laugerei“ gereinigt und mit Schwefelsäure versetzt. (TIPP: Wichtig ist hier, dass „Auslaugen“ im Sinne von „reinigen“, „waschen“ gemeint ist und nichts mit der Behandlung mit Hydroxidlösungen zu tun hat) Zink reagiert mit der Schwefelsäure zu Zinksulfat, während Eisen, Blei und Silber ungelöst abgetrennt werden können.
Zn2+O2- + (H+)2(SO4)2- → Zn2+(SO4)2- + H2O
Die Zinksulfatlösung wird nun elektrolytisch getrennt. Reines Zink scheidet sich als leicht abtrennbare Schicht auf der Oberfläche der als Kathode geschalteten Aluminiumbleche ab, an der Anode entsteht durch Reaktion des Wassers mit dem Säurerest (vereinfacht dargestellt) wieder Schwefelsäure und Sauerstoff steigt auf.
Kathode:
Zn2+ + 2 e → Zn
Anode:
H2O + (SO4)2- → (H+)2(SO4)2- + O2-
O2- – 2 e → 1/2 O2
Zinkblech wird zu über 90 % recycelt
Metallischer Zinkschrott kann ohne Qualitätsverlust immer wieder recycelt und zu neuen Zinkprodukten verarbeitet werden, die dabei benötigte Energie beträgt nur etwa nur 5 % der Energie, die für die Zinkgewinnung aus Erzen aufgewendet werden muss. Auch die Zinküberzüge von Stahl werden zurückgewonnen. Beim Stahl-Recycling wird der Stahlschrott eingeschmolzen, das enthaltene Zink wird gasig und schlägt sich an den Stäuben nieder, die aus dem Prozess herausgefiltert werden. Dieser zinkhaltige Staub wird dem Zinkgewinnungsvorgang zugeführt.