Kraftstoffe
Folie 7 & 8: Klassische Kraftstoffe
Eine interaktive Übung zum Thema „Klassische Kraftstoffe“ finden Sie hier:
Die klassischen Kraftstoffe werden aus Erdöl gewonnen. Bedingt durch seine Entstehung aus organischem Material unter Luftabschluss besteht Erdöl aus Kohlenwasserstoffverbindungen. Dieses Wissen und Grundkenntnisse über Alkane, Isomerie, Mehrfachbindungen und ringförmige Strukturen werden hier vorausgesetzt.
Die Abbildung oben gibt einen kurzen Überblick über die einzelnen Fraktionen. Benzin und Diesel sind hervorgehoben. Da Siedebereiche angegeben sind, können die Schülerinnen und Schüler schließen, dass es sich bei den Fraktionen um Gemenge handelt. Die Siedetemperaturunterschiede zwischen Benzin und Diesel zeigen, dass Diesel aus größeren, wahrscheinlich längerkettigen Kohlenwasserstoffen besteht. Vergleicht man die Viskosität von Benzin und Diesel, erhärtet sich die Vermutung. Diesel hat eine zehnmal höhere Viskosität als Benzin. Das bedeutet, dass die zwischenmolekularen Anziehungskräfte zwischen den größeren Dieselmolekülen höher sind, als die zwischen den kleineren Benzinmolekülen.
Verfahren der Benzinherstellung
Die Abbildungen in der Mitte zeigen die chemischen Umwandlungen zur Anpassung des Rohbenzins an die Erfordernisse im Motor.
Abbildung Mitte links: Cracken
Der Anteil an Benzin, der durch Destillation aus dem Erdöl gewonnen wird, deckt in keiner Weise den weltweiten Bedarf. Deshalb gewinnt man auf chemischem Wege, durch Cracken, aus den zähflüssigen, hoch siedenden Rückständen weiteres Benzin.
Thermisches Cracken:
Heizöl S und Bitumen werden unter Druck auf 600 °C erhitzt. Dabei entstehen niedrig siedende Benzinfraktionen und Gase. Dieses Verfahren wird zur Benzingewinnung nicht mehr angewandt, weil die Crackprodukte zu kurzkettig, unverzweigt und häufig ungesättigt (Olefine) sind. Zur Herstellung von Olefinen als Ausgangsprodukte für die Kunststoffindustrie wird es jedoch weiterhin durchgeführt. Bei den Verfahren des katalytischen Crackens handelt es sich v. a. um das Fluid Catalytic Cracking (FCC), das überwiegend zur Gewinnung von Benzin eingesetzt wird und das Hydrocracken, bei dem hochwertiges Gasöl und Kerosin entstehen.
Fluid Catalytic Cracking (FCC):
Bei Temperaturen bis 500 °C werden unter Normaldruck die hoch siedenden Rückstände am Katalysator in benzintaugliche Verbindungen zerlegt. Eine ständige Regenerierung des Katalysators ist nötig, da dieser sich mit Kohlenstoff belädt.
Die Verbrennung dieses Kohlenstoffs liefert aber wieder die Energie für die Erhitzung des Schweröls. Dieses Verfahren wird überwiegend zur Benzingewinnung angewandt (Festbett-Technologie). Bei Temperaturen bis 400 °C werden unter Hochdruck (100 – 150 bar) und Wasserstoffzufuhr am Katalysator die Rückstände in Cycloalkane zerlegt. Das Hydrocracken ist gut geeignet zur Gewinnung von hochwertigem Gasöl und Kerosin, nicht aber von Benzin, da die hoch klopffesten Aromaten durch Wasserstoffanlagerung in weniger klopffeste Cycloalkane umgewandelt werden. Was passiert nun eigentlich beim Cracken? Beim Cracken (to crack, engl. zerbrechen, aufspalten) werden langkettige Kohlenwasserstoffmoleküle in kürzere umgewandelt. Aus hoch siedenden Fraktionen entstehen niedrig siedende. Hierbei fallen größere Mengen kurzkettige, gasige und ungesättigte Kohlenwasserstoffe an, die durch Polymerisieren in einem Reaktor zu überwiegend verzweigten Iso-Alkanen verbunden werden. Es entsteht sogenanntes Polymer-Benzin oder Polymerisat.
Abbildung Mitte rechts: Reformieren:
Beim Reformieren entsprechen die Ausgangsverbindungen aus dem Schwerbenzin zwar im Molekulargewicht denen, die man für Otto-Kraftstoffe braucht, sie haben aber zu niedrige Oktanzahlen (oder Octanzahlen) und müssen deshalb in Kohlenwasserstoffe mit hohen Oktanzahlen, also in verzweigte und ringförmige Verbindungen, umgewandelt werden. Dazu wird das Schwerbenzin unter erhöhtem Druck (15 – 50 bar) und erhöhter Temperatur (~500 °C) in Gegenwart des Katalysators Platin zur Reaktion gebracht. Neben den klopffesteren Benzinbestandteilen fällt dabei auch Wasserstoff an.
Zusammensetzung der Kraftstoffe
Diesel-Kraftstoff
→ Gemenge aus geraden, verzweigten und ringförmigen Kohlenwasserstoffen mit 10 – 22 C-Atomen.
Otto-Kraftstoff = Benzin oder Superbenzin
→ Gemenge aus geraden, verzweigten und ringförmigen Kohlenwasserstoffen mit 5 – 9 C-Atomen.
Die verschiedenen Kohlenwasserstoffverbindungen in Kraftstoffen.
Die untere Abbildung zeigt eine Einteilung brennbarer Stoffe nach der Chemikalienverordnung (EU 1272/2008 (CLP)) bezüglich ihrer Flammpunkte. So müssen Stoffe mit einem Flammpunkt unter 0 °C als hochentzündlich, Stoffe mit Flammpunkten zwischen0 °C und 21 °C als leichtentzündlich und Stoffe mit einem Flammpunkt ab 21 °C bis 55 °C als entzündlich nach der Gefahrstoffverordnung gekennzeichnet sein und die jeweiligen R- und H-Sätze beachtet werden.
Der Flammpunkt eines Stoffes ist nach DIN 14011 (Juni 2010) die niedrigste Flüssigkeitstemperatur, bei der sich unter festgesetzen Bedingungen Dämpfe in solcher Menge entwickeln, dass über dem Flüssigkeitsspiegel ein durch Fremdzündung entzündliches Dampf-Luft-Gemisch entsteht. Der Flammpunkt ist ausschlaggebend bei der Einstufung und Klassifizierung als Gefahrstoff. Für die Messung des Flammpunktes gibt es vier nach DIN standadisierte Methoden. Da die Flammtemperatur von Otto-Kraftstoff deutlich unter 21 °C (von -45 °C bis +10 °C) liegt, besteht an Tankstellen die Gefahr der Entzündung (höchste Gefahrklasse, Warnhinweise).
Hier kann man wieder den Zusammenhang zwischen Molekülgröße und Siedetemperatur herstellen. Benzin besteht aus kleineren Molekülen und hat eine niedrigere Siedetemperatur, wie schon aus der Erdölfraktion ersichtlich. Deshalb verdunstet Benzin bei niedrigen Temperaturen, d. h. bei üblichen Außentemperaturen ist ein Luft-Benzindampf-Verhältnis erreicht, das sich leicht entzündet.
Diesel dagegen verdampft erst bei sehr viel höheren Temperaturen aufgrund seiner größeren Moleküle. Deswegen ist er erst bei höheren Temperaturen entflammbar (siehe Kopiervorlage 14: Siedetemperaturen und Flammpunkte von Kraftstoffen).
Die Zündtemperatur ist die Temperatur, bei der sich eine brennbare Flüssigkeit oder ein brennbares Gas nach Einbringung in ein erwärmtes Zündgefäß entzündet. Die Zündtemperatur wird nach DIN 51794 bestimmt. Sie ist eine Kenngröße z. B. zur Festlegung der zulässigen Oberflächentemperatur von Maschinen oder elektrischen Anlagen.
Die Zündtemperatur der Kohlenwasserstoffe sinkt im Gegensatz zum Flammpunkt mit steigender Molekülmasse, weil bei den längeren Molekülketten durch die Bewegung bei der Erwärmung die Elektronenpaarbindungen leichter aufbrechen. Hierbei entstehen Kohlenwasserstoff- und Wasserstoffradikale, die leicht mit Sauerstoff reagieren. Die Zündtemperatur von Benzin liegt zwischen 200 und 400 °C, die von Diesel zwischen 220 und 300 °C.
Flammpunkt Diesel-Kraftstoff: > 55 °C
Zündtemperatur Otto-Kraftsstoff: 200 °C bis 400 °C
Zündtemperatur Diesel-Kraftstoff: 220 °C bis 300 °C
Verbrennungstemperatur
Gemisch Kraftstoff / Luft: 2.000 °C bis 2.500 °C
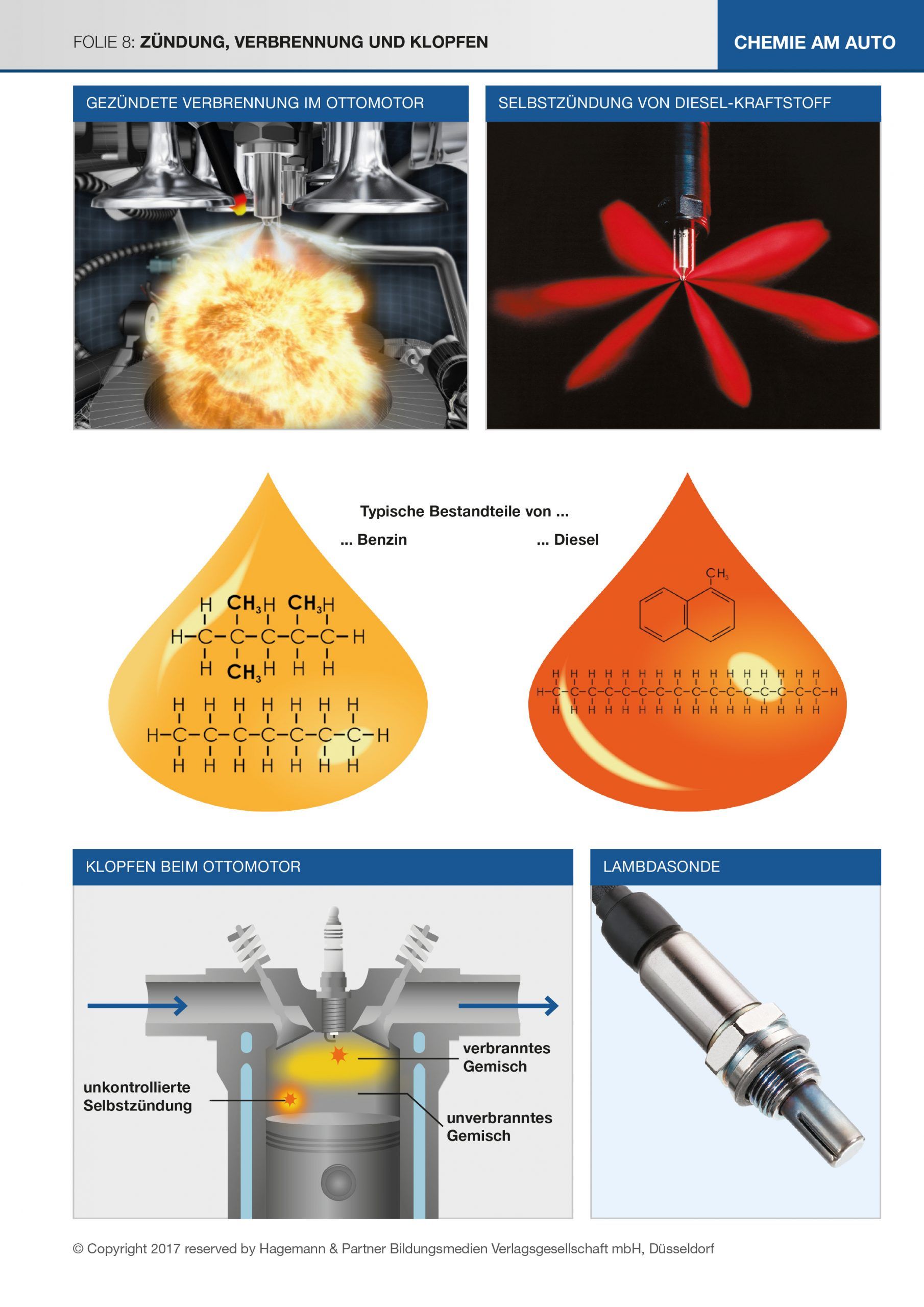
Die Abbildungen links und rechts oben stellen die unterschiedlichen Zündvorgänge beim Ottomotor und beim Dieselmotor dar. Beim Ottomotor wird das Kraftstoff-Luftgemisch durch die Zündkerze gezündet. Beim Dieselmotor wird die Ansaugluft im Brennraum stark verdichtet. Dadurch erhitzt sie sich, sodass sich der eingespritzte Diesel-Kraftstoff darin nach möglichst kurzer Zeit (Zündverzug ~0,001 s) von selbst entzündet.
Langkettige Moleküle im Diesel zerfallen unter dem Druck und der Hitze im Brennraum in kleinere Molekülbruchstücke, die sich mit Sauerstoff verbinden. Bei ausreichender Sauerstoffzufuhr entstehen schließlich Kohlenstoffdioxid und Wasserdampf (siehe auch Zündtemperatur).
Abbildungen Mitte links und rechts:
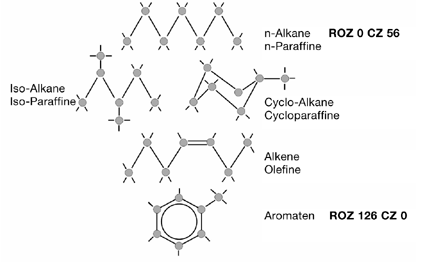
Sowohl beim Otto- als auch beim Diesel-Kraftstoff spielt das Zündverhalten im Motor eine wichtige Rolle. Angegeben wird dies jeweils durch einen Kennwert. Beim Benzin ist das die ROZ (Research Oktanzahl, meist einfach Oktanzahl), beim Diesel die CZ (Cetanzahl). Die Abbildungen zeigen die Referenzverbindungen.
(ROZ: Research Oktanzahl)
Referenzverbindungen:
n-Heptan:
→ ROZ 0 → keine Klopffestigkeit
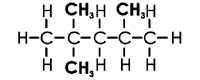
Iso-Oktan (2,2,4 Trimethylpentan):
→ ROZ 100 → hohe Klopffestigkeit
Aromaten = ringförmige ungesättigte Kohlenwasserstoffe (Beispiel Benzol) haben eine hohe Klopffestigkeit. Seit 1998 darf wegen der krebserzeugenden Wirkung nur noch max. 1 % Benzol im Kraftstoff enthalten sein.
früher Bleialkyle: Bleitetraethyl TEL (C2H5)4 Pb und Bleitetramethyl → heute verboten (unverbleites Benzin darf jedoch noch max. 0,013 g/l Blei enthalten).
Bei zu hohem Bleigehalt im Benzin entsteht Bleistaub im Abgas, der sich an der Lambdasonde und an den aktiven Zentren des Katalysators absetzt und diese Komponenten unbrauchbar macht.
Alkohole haben ebenfalls eine hohe Klopffestigkeit → in heutigen Otto-Kraftstoffen enthalten.
Etha-Zusätze: MTBE (Methyl-Tertiär-Butylether)
(CZ: Cetanzahl)
Referenzverbindungen:
Cetan = n-Hexadecan
→ CZ 100 → hohe Zündwilligkeit
Methylnaphthalin
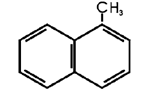
CZ 0
→ niedrige Zündwilligkeit
Dieselkraftstoff mit der Cetanzahl 51 verhält sich wie ein Gemisch aus 51 % Cetan und 49 % Methylnaphthalin. Es sagt nichts über die tatsächliche Zusammensetzung des Kraftstoffes aus.
CZ heutiger Diesel-Kraftstoffe: 51 – 55 (Super Diesel)
(„Shell V- Power“ und „Aral Ultimate“ haben fast CZ 60)
Zündbeschleuniger erhöhen die Zündwilligkeit (0,1 – 1 Vol.%)
Bei Diesel-Kraftstoff ist die Zündunwilligkeit der ringförmigen Verbindungen ein Nachteil, bei Otto-Kraftstoff ein Vorteil (Klopffestigkeit). Die Qualität des Diesel-Kraftstoffes steigt also mit dem Anteil der geradkettigen Kohlenwasserstoffe, die des Otto-Kraftstoffes mit dem Anteil der verzweigten und ringförmigen Anteile. Beim Ottomotor muss sichergestellt sein, dass der Kraftstoff ausschließlich durch die Zündkerze gezündet wird. Jede andere Zündung verschlechtert die Leistung des Motors erheblich und führt zu rascherem Verschleiß. Beim Dieselmotor soll sich der Kraftstoff selbst zünden, d. h. er muss in einem weiten Außentemperaturspektrum besonders zündwillig sein.
Abbildung links unten:
Das Klopfen im Ottomotor entsteht (sehr vereinfacht), wenn während der gleichmäßigen Verbrennung an der Flammenfront das noch unverbrannte Gemisch unkontrolliert zu zünden beginnt. Die höhere Ausbreitungsgeschwindigkeit der Flamme, die mit diesem Vorgang einhergeht, führt zu einem schnelleren und stärkeren Druckanstieg im Zylinder und damit zu einem stärkeren Verschleiß bei verminderter Leistung. Der Begriff „Klopfen“ ist auf das im Fahrzeuginnenraum wahrnehmbare unruhige Motorlaufgeräusch zurückzuführen, das durch die nicht vollständig kontrollierte und ungleichmäßige Verbrennung entsteht.
Berechnung des theoretischen Luftbedarfs am Beispiel der Verbrennung von Iso-Oktan (siehe Kopiervorlage 15: Zündung und Verbrennung von Kraftstoffen):
Iso-Oktan + Sauerstoff → Kohlenstoffdioxid + Wasser
C8H18 + 12½ O2 → 8 CO2 + 9 H2O
M: 114 g/mol | 32 g/mol | 44 g/mol | 18 g/mol
m = 114 g | 400 g | 352 g | 162 g
1 kg Iso-Oktan = 8,77 Mol benötigt also (8,77 x 400 g =) 3,5 kg Sauerstoff.
Luft enthält etwa 21 Vol.% Sauerstoff und 78 Vol.% Stickstoff. Multipliziert man diese Volumenverhältniszahlen jeweils mit der Molmasse von O2 (32 g/mol) und N2 (28 g/mol), so erhält man ein Gewichtsverhältnis von Sauerstoff zu Stickstoff in der Luft von 1 : 3,25. Die Luftmenge, die 3,5 kg Sauerstoff enthält, enthält also (3,25 x 3,5 =) 11,38 kg Stickstoff. Der theoretische Luftbedarf für die Verbrennung von 1 kg Iso-Oktan beträgt also (3,5 kg +
11,38 kg =) 14,88 kg. Bei einer Dichte der Luft von 1,2 kg/m3 entspricht das (14,88 : 1,2 =) 12,4 m3 Luft. Da man Benzin in Volumeneinheiten misst, ist es wesentlich anschaulicher den Luftbedarf von 1 Liter Iso-Oktan zu berechnen. Iso-Oktan hat die Dichte 0,69 g/cm3. 1 Liter Iso-Oktan wiegt also 0,69 kg und benötigt damit (0,69 x 12,4 m3=) 8,6 m3 Luft. Bei der Verbrennung im Motor herrschen keine idealen Bedingungen, außerdem ist die Luftdichte abhängig von der Höhe und der Temperatur. Darüber hinaus haben wir hier reines Iso-Oktan als Rechenbeispiel genommen. Der tatsächliche Luftbedarf übersteigt also den hier berechneten theoretischen, sodass man gerundet sagen kann:
1 Liter Otto-Kraftstoff braucht bei der Verbrennung ungefähr den Sauerstoff von 10 m3 Luft.
Abbildung rechts unten:
Der tatsächliche Luftbedarf für die Verbrennung des Kraftstoffes im Motor unter den jeweiligen Bedingungen wird durch die sogenannte Lambdasonde ermittelt, die den Sauerstoffgehalt der Abgase vor dem Eintritt in den Katalysator misst. Über ein Steuergerät regelt diese Messung die Zusammensetzung des Kraftstoff-Luft-Gemenges, das in den Brennraum geführt wird. Der Luftbedarf im Motor errechnet sich aus dem theoretischen Luftbedarf multipliziert mit der ermittelten Luftzahl λ.
L (tatsächlicher Luftbedarf) = λ (Luftzahl) * L0 (theoretischer Luftbedarf)
Ist der Lambdawert klein, spricht man von einem „fetten“ Gemisch (viel Kraftstoff im Verhältnis zur Luft), ist der Lambdawert groß, spricht man von einem „mageren“ Gemisch (wenig Kraftstoff im Verhältnis zur Luft). λ = 1 entspricht dem theoretischen Luftbedarf bei der Verbrennung. Bei Verwendung magerer Kraftstoffgemische ist eine Kraftstoffeinsparung von bis zu 15 % möglich. Der λ -Wert für Ottomotoren liegt zwischen 0,85 und 1,25, der für Dieselmotoren zwischen 1,2 und 2. Welche Wirkung sich durch die Veränderung der Luftzufuhr zu einem brennbaren Stoff erzielen lässt, kann man in der Schule am leichtesten am Gasbrenner demonstrieren. Bei nicht geöffneter Luftzufuhr wird der Brennstoff unvollständig verbrannt, was man an der Entwicklung unverbrannten Kohlenstoffs leicht erkennt (Abscheidung an Magnesiarinne), die Temperatur ist deutlich niedriger als bei geöffneter Luftzufuhr. Die nicht leuchtende Flamme ist erheblich heißer und brennt rußfrei.