Elektrische Energiespeicher
Folie 10: Elektrische Energiespeicher
Eine interaktive Übung zum Thema „Elektrischer Energiespeicher“ finden Sie hier:
Ungeachtet langjähriger, fast hektischer Forschungsarbeit an geeigneten Energiespeichersystemen ist auch heute noch der Bleiakkumulator der am weitesten verbreitete Energieträger in Fahrzeugen. Früher verloren die Bleiakkus Wasser durch Verdunstung und das Entweichen von Wasserstoff und Sauerstoff („Gasen“). Heute verwendet man verschlossene (wartungsfreie) Bleiakkus, deren Zellen zugeschweißt sind und die lediglich ein Überdruckventil besitzen. Das Gasen verhindert man, indem die Bleigitter mit Antimon versetzt werden, das die Überspannung von Wasserstoff und Sauerstoff an den Elektroden erhöht.
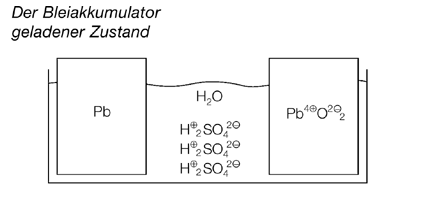
Bleiakkumulator
Die Abbildung oben zeigt den Aufbau eines Bleiakkus. Das positive Gitter ganz links wird durch Umhüllung mit der sogenannten aktiven Masse, die überwiegend aus Bleidioxid besteht, zur positiven Platte. Diese wird dann wie in einem Briefumschlag von dem Mikroglasvlies-Separator, also einer Trennschicht umhüllt, die die Berührung mit der negativen Platte und damit einen Kurzschluss verhindert. Die negative Platte entsteht entsprechend, sie besteht überwiegend aus Blei, benötigt aber keine Trennschicht mehr, da die positive Platte bereits eingehüllt ist. Mehrere dieser positiven und negativen Platten werden nun zu Plattensätzen zusammengeschaltet (Oberflächenvergrößerung) und zu einem Plattenblock ineinander geschoben. Ein solcher Plattenblock liefert eine Spannung von etwa 2 Volt. Für eine 12-Volt-Starterbatterie werden also sechs dieser Blocks zusammengeschaltet. Die hier dargestellten Glasfaserseparatoren gehören zu hochwertigen Starterbatterien. Sie enthalten ein Kapillarnetz, das den Elektrolyten, die Schwefelsäure, aufsaugt, sodass diese nicht mehr beweglich ist, also nicht auslaufen kann.
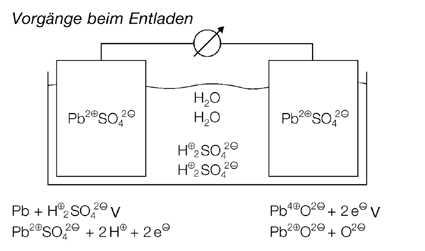
Abbildungen Mitte links und rechts:
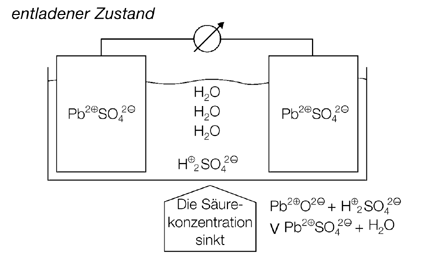
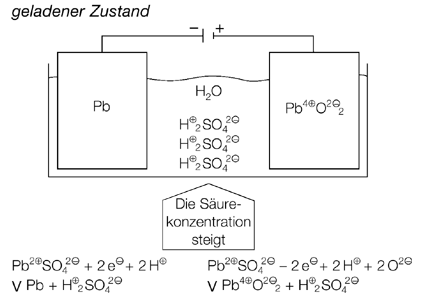
Entsprechend den Beobachtungen bei Versuch 1 (Kopiervorlage 23) zeigen die Abbildungen, dass die Bleibleche sich im geladenen Zustand des Akkus chemisch unterscheiden, im entladenen Zustand aber gleich sind. Die Darstellungen zeigen darüber hinaus, dass sich auch die Säurekonzentration bei diesen Vorgängen verändert.
Versuch 1 zeigt, dass man einen Bleiakku immer wieder aufladen kann (Akkumulator = Sammler, Energiesammler oder -speicher). Dies unterscheidet ihn von einer Batterie. Schüler kennen aus dem Hausgebrauch Batterien, die nach Entleerung entsorgt werden müssen sowie die wieder aufladbaren Akkus. Nicht aufladbare Energiespeicher werden auch als Primärelement, aufladbare als Sekundärelement bezeichnet.
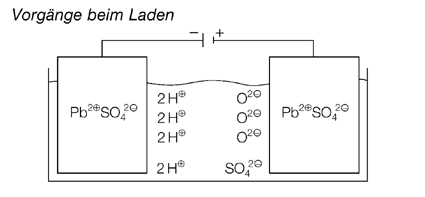
Die chemischen Abläufe beim Entlade- und Ladevorgang sind in den folgenden Abbildungen dargestellt. Vom metallischen Blei am Minuspol fließen Elektronen zum Bleidioxid des Pluspols, was als Stromfluss genutzt, bzw. gemessen werden kann. Beim Laden wird an der als Kathode geschalteten Seite das Pb2+-Ion zu metallischem Blei reduziert, während es an der Anode zum Pb4+-Ion oxidiert wird. Man kann an diesen Vorgängen den erweiterten Reduktionsbegriff als Elektronenaufnahme und den Oxidationsbegriff als Elektronenabgabe wiederholen oder einführen.
Wie erfolgt nun der Ladevorgang im Auto? Der Bleiakkumulator dient im Auto im Wesentlichen als Starterbatterie. Dieser Vorgang benötigt besonders bei kalten Temperaturen viel Energie. Bei laufendem Motor wandelt die Lichtmaschine – ein Dynamo, der vom Keilriemen angetrieben wird – mechanische Energie in elektrische Energie um, mit der der Akku während der Fahrt geladen wird.
Wie die folgende Darstellung zeigt, ändert sich die Schwefelsäurekonzentration des Bleiakkus mit dem Ladezustand. Im geladenen Zustand beträgt die Säurekonzentration 37 % und sinkt während des Entladevorgangs stetig ab. Proportional zur Säurekonzentration ändert sich auch die Säuredichte. Sie beträgt im geladenen Zustand des Akkus etwa 1,28 g/cm3, bei entladenem Akku ca. 1,10 g/cm3. Der Ladezustand eines Bleiakkumulators mit flüssiger, nicht aufgesogener Säure lässt sich also mit Hilfe eines Dichtemessers oder Aräometers ermitteln, der in den Werkstätten als „Säureheber“ bekannt ist. Dies kann man im Unterricht leicht vorführen.
Nickel-Metall-Hydrid-Akkumulator
Die Abbildung unten links zeigt den schematischen Aufbau eines Nickel-Metall-Hydrid-Akkumulators. Wie im Bleiakku sind mehrere Metallhydridplatten pro Einheit zur negativen Elektrode zusammengeschlossen, zwischen die – durch Separatoren getrennt – Platten aus Nickeloxidhydrat als positive Elektrode geschoben sind. Mehrere dieser Einheiten sind wiederum miteinander verbunden, um die erforderliche Spannung zu liefern. Auch dieser Akku hat ein Sicherheitsventil, das einen Überdruck durch Gasbildung im Gehäuse verhindert. Der Nickel-Metallhydrid-Akkumulator wird in absehbarer Zeit den Nickel-Cadmium-Akkumulator ablösen, um auf das giftige Schwermetall Cadmium verzichten zu können. Bei Kleingerätebatterien hat er bereits einen Marktanteil von über 30 %. Beide Energiespeicher sind alkalische Systeme mit Kalilauge als Elektrolyt. Im Gegensatz zum Bleiakku nimmt der Elektrolyt nicht an der elektrochemischen Reaktion teil und verändert daher nicht seine Konzentration. Ein Metallhydrid ist eine Metalllegierung, an deren Oberfläche Wasserstoffmoleküle absorbiert und in Wasserstoffatome gespalten werden. Diese Atome wandern aufgrund ihres geringen Atomdurchmessers in das Metallgitter und bilden mit ihm eine Art Legierung. Das Metall verändert dadurch seine Eigenschaften, es wird spröde (Wasserstoffversprödung). Ein solches Metallhydrid (MH) bildet jeweils den Minuspol einer NiMH (Nickel-Metall-Hydridzelle). Den Pluspol bildet Nickeloxidhydrat (NiOOH).
Entladung
Minuspol
MH + OH– → M + H2O + e–
Der Wasserstoff aus dem Metallhydrid wird oxidiert (gibt ein Elektron ab), das Proton verbindet sich mit einem Hydroxidion aus der Lauge zu Wasser.
Pluspol
NiOOH + H2O + e–→ Ni(OH)2 + OH–
Dreiwertiges Nickeloxidhydrat [Ni(III)O(OH)] wird zu Nickelhydroxid [Ni(II)(OH)2] reduziert. Hierbei entstehen wieder Hydroxidionen, sodass die Konzentration der Lauge unverändert bleibt.
Die negative Elektrode ist stets überdimensioniert, damit bei Tiefentladung nur die positive Elektrode ganz entladen, die Metallhydrid-Elektrode dagegen nur teilentladen wird. So kann es nicht zur Oxidation des Metalls anstelle des Wasserstoffs kommen. Bei der Aufladung werden die Reaktionen umgekehrt. Es gibt bereits einen Pkw, bei dem ein Nickel-Metall-Hydrid-Akkumulator einen Elektromotor antreibt, den Prius von Toyota. Er besteht aus 228 in Reihe geschalteten Zellen mit einer Kapazität von je 6,5 Ah. Die Zellen stellen eine Spannung von 228 × 1,2 V = 273,6 Volt bereit. Die Entladung ist auf 40 % der Gesamt-Energie von 273,6 V × 6,5 Ah = 1750 Wh begrenzt. Einschließlich Ladeelektronik weist die Batterie eine Masse von 53,3 kg auf. Im alltäglichen Gebrauch werden NiMH-Speicher als Knopfzellen und Rundbatterien verwendet, bei denen der Elektrolyt eingedickt ist. Außerdem liefern sie auch in Hörgeräten, Taschenlampen, Rasierapparaten, Blitzgeräten, schnurlosen Telefonen, Camcordern etc. Energie.
Lithium-Ionen-Akkumulator
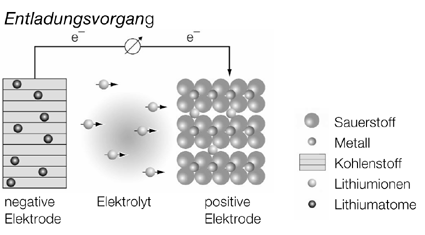
Die Abbildung unten rechts auf der Folie zeigt den prinzipiellen Aufbau eines Lithium-Ionen-Akkumulators:
Links: die negative Elektrode aus Kupfer mit dem Lithiumgraphit (rosa)
Mitte: der für Lithiumionen durchlässige Keramik-Separator (blau), eingebettet in den Elektrolyten
Rechts: die positive Elektrode aus Aluminium mit dem Metalloxid (hellblau)
Beim Entladen fließen die Elektronen vom Lithiumgraphit zum Metalloxid, die Lithiumionen wandern durch den Elektrolyten in dieselbe Richtung.
Beim Laden fließen die Elektronen vom Metalloxid zum Lithiumgraphit, die Lithiumionen wandern ebenfalls in diese Richtung. Lithium-Ionen-Akkumulatoren spielen heute im Elektronikbereich für Geräte mit hohem Energiebedarf eine wichtige Rolle, da sie eine hohe Energiedichte aufweisen. Wir kennen sie aus Laptops, Camcordern, Digitalkameras und Mobiltelefonen. Die negative Elektrode besteht aus einer Lithium-Kohlenstoff-Verbindung. Das Lithium ist in den Kohlenstoff verbindungs- oder eher legierungsähnlich eingelagert, man spricht von einer Intercalationselektrode (Intercalation = Einlagerung). Die positive Elektrode besteht aus Metalloxiden, oft aus Mischoxiden (z. B. „Drittelmaterial“: ein Drittel Cobalt, ein Drittel Nickel und ein Drittel Mangan). Auch in diese Elektrode werden die Lithiumionen eingelagert, man erhält also keine stöchiometrischen Verbindungen. Bei der Entladung fließen die Elektronen von der Kohlenstoffelektrode zur Metalloxidelektrode. Gleichzeitig wandern die Lithiumionen durch den Elektrolyten vom Kohlenstoff zum Metalloxid.
Entladungsvorgang
Für den Vergleich verschiedener Akkumulatoren sind bestimmte physikalische Parameter von Bedeutung:
Ruhespannung, das ist die Spannung zwischen den beiden Polen, wenn kein Strom fließt; sie wird durch die verwendeten Elektrodenmaterialien bestimmt
Gewichts-bzw.volumenbezogene Speicherkapazität (theoretisch entnehmbare Ladungsmenge in Ah/kg bzw. Ah/l)
spezifische Energie bzw. Energiedichte (masse- bzw. volumenbezogene nutzbare elektrische Energie einer Batterie in Wh/kg bzw. Wh/l)
Vergleich verschiedener Akkusysteme
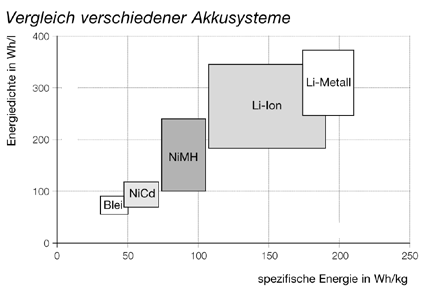
Diese obige Darstellung sowie die unten stehende Tabelle verdeutlichen die Vorteile der neuen Akkusysteme aus Metallhydrid oder Lithium in Bezug auf die Verringerung von Gewicht und Volumen bei gleicher Leistung. Der Li-Ionen-Akku liefert darüber hinaus eine deutlich höhere Spannung
Vergleich von Kenndaten der drei Akkumulatoren:
| Batteriesystem | Pb/PbO2 | NiMH | Li-Ion | |
| Energiedichte massebezogen |
Wh/kg | 35 | 66 | 149 |
| Energiedichte volumenbezogen |
Wh/l | 100 | 137 | 313 |
| Leistungsdichte massebezogen |
W/kg | 100 | 150 | 664 |
| Leistungsdichte volumenbezogen |
W/l | 230 | 310 | 1392 |
| Zellenspannung | V | 2,0 | 1,2 | 3,6 |
Literatur
- Wikipedia Nickel-Cadmium-Akkumulator/Lithium-Ionen-Batterie
- Varta Internetseite
- Internetseite Fa. PSS GmbH & Co. KG (www.pss-battery.de)
- CHEMKON 2005, 12, Nr. 1 „Lithium-Batterien“
- GDCh Internetseite Lithiumbatterien
