Metalle
Folie 1: Eisen und Aluminium
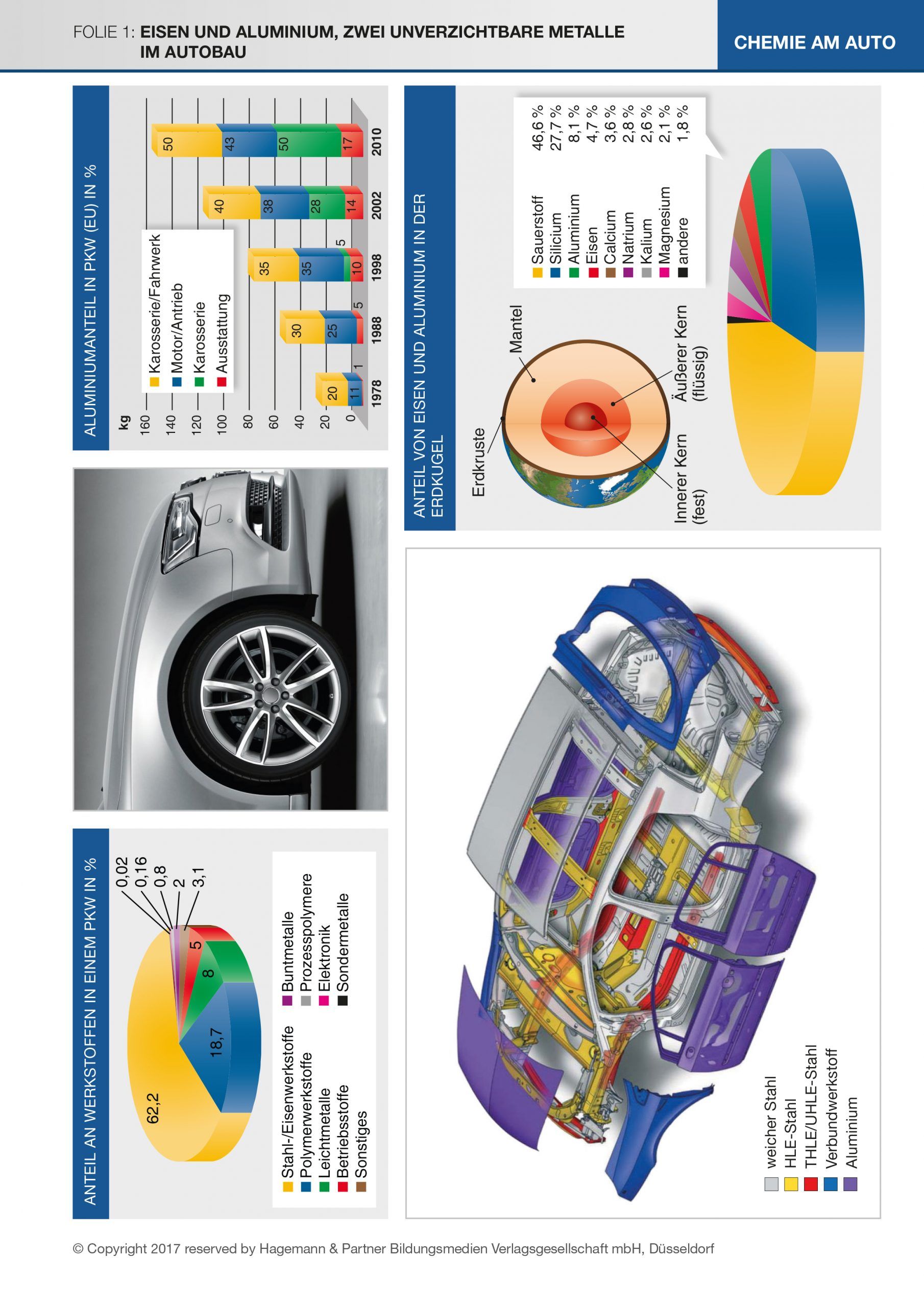
Folie 1 zeigt das Vorkommen von Eisen und Aluminium in der Natur sowie die Verbreitung und den Einsatz der Metalle als Werkstoffe im Automobilbau.
Abbildungen oben und links unten:
Schon in der siebten Klasse können bei der Beschreibung der Stoffeigenschaften diese Beispiele aus der Alltagswelt eingesetzt werden. Die Abbildung oben links zeigt, in welchen Anteilen verschiedene Werkstoffe im PKW eingebaut werden. Vergleicht man die Gewichtsanteile von Eisen und Aluminium im Auto, fällt zuerst der sehr viel höhere Eisenanteil auf. Bei einem Gesamtgewicht eines Mittelklasse-PKW von etwa 1,5 t und einem Aluminiumanteil von 140–150 kg für 2012 macht der Aluminiumanteil annähernd 10 % aus. Bezogen auf das Gewicht enthält ein Auto etwa sechsmal so viel Eisen wie Aluminium, bezogen auf das Volumen nur etwa doppelt so viel. Hier lassen sich die Stoffeigenschaft der Dichte anwenden und dabei erste Überlegungen anstellen, welche Bedeutung das Gesamtgewicht und damit die Materialauswahl für die PKW-Produktion hat. Ein Grund dafür, dass der Anteil von Aluminium stetig steigt. Eisen und Aluminium finden heutzutage in fast allen Bereichen unseres täglichen Lebens Verwendung. Indem die Schülerinnen und Schüler sich darüber Gedanken machen, ergibt sich ganz selbstverständlich die Frage nach der Herkunft dieser Stoffe.
Abbildung rechts unten:
Aus dieser Grafik kann man entnehmen, in welcher Menge Eisen und Aluminium jeweils in der Erdkugel vorkommt. Dabei „verstecken“ sich die Reinstoffe in Verbindungen wie Gesteinen oder Erzen und sind vermengt mit anderen Bestandteilen der Erdoberfläche. Wenn die unterschiedliche Reaktivität der Metalle bereits besprochen wurde, können die Schülerinnen und Schüler schon aus dem unedlen Charakter der Metalle schließen, dass diese nur in gebundener Form und nicht wie die Edelmetalle gediegen in der Natur vorkommen können. Die metallhaltigen Verbindungen müssen also zuerst mit physikalischen Methoden von den anderen Gemengebestandteilen getrennt und anschließend die Metalle auf chemischem Wege aus der Verbindung reingewonnen werden. Der Name „Magnetit“ für eines der Eisenerze weist auf die magnetischen Eigenschaften hin und führt so zu Überlegungen, mit welchen Trennverfahren man die Metallverbindungen von den übrigen Beimengungen trennen kann, was natürlich aus Gründen der Kostenersparnis direkt vor Ort geschieht. Hier wird nur an allgemeine Verfahren gedacht: Sieben, Ausschütteln (hohe Dichte von Eisenverbindungen) etc.
Magnetit (Magneteisenstein) ist das schwarze, stark magnetische Eisen(II, III)-oxid (Fe3O4) mit einem zweiwertigen und zwei dreiwertigen Eisenionen auf vier Sauerstoffionen im Gitter. Seine Dichte beträgt 5,2 g/-cm3.
Hämatit (Roteisenstein, Bluteisenstein) ist das grauschwarze bis rotbraune, in reiner Form unmagnetische Fe2O3. Das Schleifwasser ist immer blutrot und erklärt den Namen des Erzes.
Bauxit besteht zu 35 - 65 % aus Aluminiumoxid (Al2O3) sowie Sand und Eisenoxid. Es ist der Ausgangsstoff für die Aluminiumindustrie. Dabei enthält das Aluminiumoxid stets Wasser und bildet im Mengenverhältnis unterschiedlich zusammengesetzte Kristalle, die Sauerstoffatome und OH-Gruppen enthalten: Al2O3· x H2O, Al(OH)3, AlO(OH). Al(OH)3 kommt in der Natur vor als Gibbsit [γ-Al(OH)3] und als Bayerit [β-Al(OH)3]. AlO(OH) kommt in der Natur vor als Diaspor [α-AlO(OH)] und als Böhmit [γ-AlO(OH)].
Feldspat, Glimmer und Kaolin (Porzellanerde, reiner Ton) sind Alumosilikate. Korund ist natürliches Al2O3, als Rubin bekannt, wenn es durch Chromionen rot gefärbt ist, als Saphir, wenn es durch Eisen(II, III)-Ionen und durch Titan(IV)-Ionen blau gefärbt ist. Eisenerz wird mit physikalischen Methoden von Gesteinsbeimengungen getrennt. Bauxit wird im BAYER-Prozess vorbereitet. Dabei wird das Bauxit unter Druck und Hitze mit Natronlauge zu Aluminiumhydroxid umgesetzt, das durch Glühen zu Aluminiumoxid gebrannt wird. Pro Tonne gebildetem Aluminiumoxid fallen dabei etwa 700 kg Rotschlamm an. Dieser hat seine Farbe vom Eisen(III)-oxid und enthält außerdem Titanverbindungen, Reste ungelöster Aluminiumverbindungen sowie fast 50 % Wasser. Reste von Natronlauge werden zurückgewonnen und erneut in den BAYER-Prozess eingespeist. Der Rotschlamm, der geringe Mengen giftiger Stoffe wie Arsen, Chrom und Quecksilber enthält, wird in Deutschland sorgfältig deponiert.
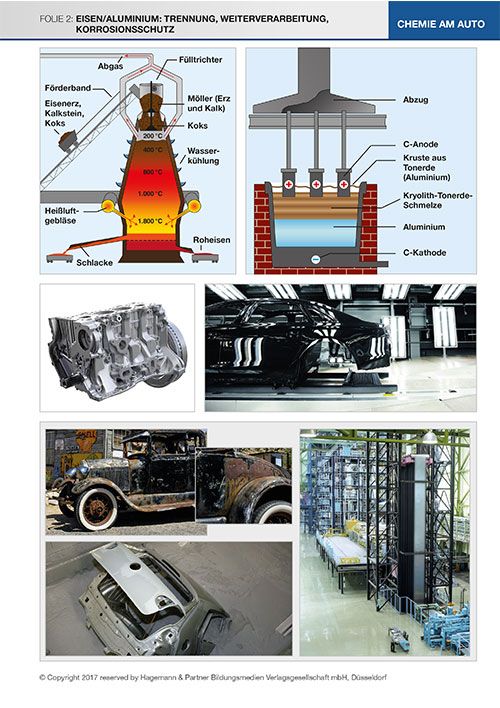
Folie 2: Trennung, Verarbeitung, Korrosionsschutz
Folie 2 zeigt die chemische Gewinnung und Aufbereitung sowie einige technische Bearbeitungsverfahren der Metalle.
Abbildung oben links:
Beide Metalle müssen aus ihren Oxiden gewonnen werden, d. h. sie müssen reduziert werden.
Der Hochofenprozess zur Eisengewinnung
Hochofenanlagen sind riesig. Außer dem bis zu 85 m hohen Hochofen selbst gehören dazu eine Gruppe von Winderhitzern, die Gichtgasreinigungsanlagen, ein bis zwei Abstichhallen, Kühlkreislaufsysteme etc. Sie erzeugen pro Tag je nach Größe zwischen 6.000 und 13.000 t Roheisen aus 8.600 bis 18.600 t Eisenerz. Hochöfen sind über etwa 10 Jahre Tag und Nacht in Betrieb, ein Abschalten und Wiederanfahren ist nicht möglich. Der Hochofen wird aber nach dieser Zeit nicht komplett ausgemustert, sondern entsprechend der aktuellen Technik gründlich überarbeitet und teilweise erneuert. Der Hochofen wird von oben abwechselnd mit Koks und einem Gemisch („Möller“) aus Eisenerz in Form von Pellets und bestimmten Zuschlägen beschickt. Die Zuschläge (Kalk, Feldspat) senken die Schmelztemperatur der verunreinigenden Gesteinsbeimengungen im Erz. Die chemischen Vorgänge beschreibt man am besten von unten nach oben. In dieser Richtung führt auf etwa 800 °C erhitzte Luft („Heißwind“) der untersten Koksschicht Sauerstoff und Energie zu.
Der Kohlenstoff oxidiert zu Kohlenstoffdioxid:
C + O2 → CO2
Diese exotherme Reaktion erzeugt Temperaturen bis zu 2.000 °C. Die darüber liegende Koksschicht reduziert bei dieser Temperatur das Kohlenstoffdioxid zu Kohlenstoffmonoxid:
2C + O2 → 2 CO
Kohlenstoffmonoxid ist ein starkes Reduktionsmittel, das das darüber liegende Eisenerz (Eisenoxid) zu Eisen reduziert:
Fe2O3 + 3 CO → 2 Fe + 3 CO2
Das flüssige Roheisen sickert in den untersten Teil des Hochofens und wird dort etwa alle 6 Stunden abgestochen, d. h. es wird über Sandrinnen in Spezialbehälter und von dort zu den Stahlwerken geleitet. Die ebenfalls flüssige Schlacke schwimmt wegen ihrer geringeren Dichte auf dem Eisen und wird separat abgezogen. Nach dem Durchströmen der verschiedenen Reaktionszonen verlässt die Heißluft nun als Gichtgas den Ofen. Ihre Zusammensetzung hat sich durch die beschriebenen und einige zusätzliche Reaktionen erheblich verändert. Neben Stickstoff und Kohlenstoffdioxid enthält das Gichtgas etwa 30 % brennbare Gase, Kohlenstoffmonoxid, Wasserstoff und Methan. Es wird durch einen Staubabscheider geleitet und unter Luftzufuhr verbrannt. Die frei werdende Wärmeenergie wird zum Erhitzen der Heißluft verwendet (Kreislauf). Wichtig ist v. a. die Unterscheidung zwischen den Verfahren: Eisenoxid wird durch Kohlenstoff (bzw. Kohlenstoffmonoxid) reduziert, Aluminiumoxid durch Schmelzflusselektrolyse. Das Prinzip der Reduktion eines Metalloxides mit dem Nichtmetall Kohlenstoff lässt sich im Schulversuch nur mit Kupferoxid statt Eisenoxid durchführen, weil die zur Reduktion des Eisenoxids nötige Energie zu hoch ist (siehe Kopiervorlage 2, Versuch 1). Man kann in Analogie zu diesem Versuch die Reduktion des Eisenoxids vereinfacht beschreiben:
2 Fe2O3 + 3 C → 4 Fe + 3 CO2
Im Zusammenhang mit Eisen bzw. Stahl als Werkstoff kommt es hier in erster Linie darauf an, deutlich zu machen, dass das entstehende Roheisen mit Kohlenstoff und anderen Begleitstoffen aus der Kohle oder dem Erz, wie Silicium, Phosphor, Mangan und Schwefel, verunreinigt ist.
Schmelzflusselektrolyse zur Aluminiumgewinnung
Abbildung oben rechts:
Bei der Schmelzflusselektrolyse von Aluminiumoxid ist die Grafitwanne des Elektrolyseofens als Kathode geschaltet, sodass sich hier das flüssige Aluminium sammelt, das von Zeit zu Zeit abgezogen wird. Die mit 2.045 °C sehr hohe Schmelztemperatur des Aluminiumoxids wird durch Zugabe von Kryolith (Na3AlF6) auf 950 °C verringert. Die in die Schmelze tauchenden anodischen Grafitblöcke reagieren mit dem hier entstehenden Sauerstoff zu Kohlenstoffmonoxid und -dioxid, sie werden also verbraucht. Aus 2 kg Aluminiumoxid (für dessen Gewinnung 4 kg Bauxit nötig sind) gewinnt man etwa 1 kg Primäraluminium, außerdem werden 0,5 kg Anoden-Grafit verbraucht. Der Prozess ist sehr energieaufwendig und deshalb teuer. Voraussetzung für das chemische Verständnis der Prozesse ist die Ionenbindung. Die Reduktion von Eisenoxid im Hochofen lässt sich mit dem eingeengten Begriff der Reduktion als Sauerstoffabgabe erklären, im Vergleich mit der Schmelzelektrolyse aber erweitern auf die Beschreibung als Elektronenaufnahme.
Abbildungen Mitte rechts und links:
Die Härte von Eisen und Aluminium (wenn man sie für die Reinstoffe überhaupt findet, siehe Kopiervorlage 1, Aufgabe 1) wird als ziemlich gering angegeben. Hieraus ergibt sich die Frage, wie aus den eigentlich ungeeigneten Metallen so leistungsfähige Werkstoffe werden. Die Stoffeigenschaften der Metalle werden durch Legierungsbestandteile erheblich beeinflusst. Das Roheisen aus dem Hochofen enthält noch Mangan, Phosphor, Silicium und Schwefelbeimengungen sowie 3 – 4 % Kohlenstoff. Es kann nur als Gusseisen verwendet werden, indem es geschmolzen und in Formen gegossen wird. Bei der Stahlherstellung werden die Beimengungen entfernt, insbesondere Kohlenstoff durch Oxidation („Frischen“). Die Verfahren werden im Kapitel „Altfahrzeug-Recycling“ beschrieben. Die unterschiedlichen Eigenschaften des Stahls werden durch Beimengung verschiedener Legierungsbestandteile erzielt. Stahl enthält definitionsgemäß weniger als 1,7 % Kohlenstoff. Im Wesentlichen beeinflussen bestimmte Metalle wie Chrom, Nickel, Wolfram, Molybdän, Vanadium und Mangan das Verhalten des Stahls. Nickelzusatz erhöht z. B. die Zähigkeit von Stahl, Chrom macht ihn härter.
Der genaue Kohlenstoffgehalt spielt ebenfalls eine wichtige Rolle. Aus Gusseisen wurden im Autobau klassischerweise Motorblöcke gegossen, wenngleich auch hier heute Leichtmetalle auf dem Vormarsch sind. Wegen der hohen Vibrations- und Schalldämpfung ist Gusseisen bei Dieselmotoren, besonders im LKW-Bereich, nicht so leicht zu ersetzen. Für die einzelnen Bauteile der Karosserie verwendet man heute verschiedene Stahlsorten (s. Folie 1, Abb. links unten). Durch Kombination der verschiedenen Stahlsorten kann eine Autokarosserie bei geringst möglichem Gewicht optimal den mechanischen und chemischen Belastungen standhalten. So muss z. B. bei einem Zusammenstoß das Material einerseits dehnbar sein, um einen möglichst großen Anteil der Aufprallenergie in Verformung umwandeln zu können, andererseits muss es fest genug sein, um die Fahrgastzelle zu stabilisieren. Zunehmend kommen hoch- und höchstfeste Stähle zum Einsatz, die hohe Festigkeit mit relativ guten Umformeigenschaften verbinden. So können einzelne Bauteile ohne Einbußen bei der Sicherheit dünner, also leichter (Kraftstoffeinsparung) gebaut werden. Aluminium wird überwiegend mit Eisen, Kupfer, Magnesium, Mangan, Zink oder Silicium legiert. Kupfer erhöht die Festigkeit, verringert aber die Korrosionsbeständigkeit. Magnesium und Mangan erhöhen die Festigkeit und Korrosionsbeständigkeit. Nickel erhöht die Festigkeit bei höheren Temperaturen. Silicium erniedrigt den Schmelzpunkt (bessere Gießbarkeit), beeinträchtigt aber das Umformen.
Abbildungen links unten:
Rostlöcher, wie man sie an sehr alten Autos findet, kommen bei modernen PKW kaum noch vor, obwohl Eisen erfahrungsgemäß rostet. Erst recht erstaunt es, dass das noch erheblich unedlere Aluminium so schön glänzend aussieht, wie bei der in Folie 1 abgebildeten Felge (oder bei der Haushaltsfolie).
Abbildungen unten links und rechts:
Stahl ist unverändert das preiswerteste Material zur Karosserieherstellung, hat aber den großen Nachteil, dass es rosten kann. Darum spielen Korrosionsschutzmaßnahmen im Karosseriebau eine wichtige Rolle. Durch weitgehenden Luft- und Feuchtigkeitsabschluss der Eisenteile kann man die Korrosion deutlich vermindern. Dazu dient eine dichte Zinkschicht ebenso wie die darüber aufgebrachte Lackierung. Für die Verzinkung gibt es zwei Möglichkeiten: Entweder werden die Karosserien durch Feuerverzinkung vollständig verzinkt. Dabei werden beispielsweise ganze PKW-Karosserien oder Anhängerfahrgestelle von LKWs in ein Bad geschmolzenen Zinks getaucht und dadurch rundum mit metallischem Zink überzogen (s. Abb. unten links). Oft werden aber nur einzelne, besonders beanspruchte Fahrzeugkomponenten zur Erzeugung besonders haltbarer Überzüge am Stück feuerverzinkt.
Im größerem Stil ist heute inzwischen die kontinuierliche Bandverzinkung (s. Abb. unten rechts) in der Anwendung, bei der Stahlblech vor der Verarbeitung zu Karosserieteilen mit einer Zinkschicht überzogen wird. Bei der Bandverzinkung wird das Stahlband in einer Schutzatmosphäre aus 5 % Wasserstoff und Stickstoff kontinuierlich geglüht, um die mechanischen Eigenschaften des Stahls zu optimieren, danach wird es durch das 460 °C heiße Zinkbad geleitet. Spezielle Abblasdüsen („Air Knifes“) streifen überschüssiges Zink ab, sodass die Überzugsdicke weniger als 7 µm beträgt. Auch die häufig angewendete elektrolytische Verzinkung erfolgt heute überwiegend in Bandverzinkungsanlagen. Diese überziehen das gereinigte Stahlband in einem meist sulfatsauren Elektrolyten mit einer Zinkschicht (siehe Kopiervorlage 5, Versuche 3a und 3b), die in der kontinuierlich arbeitenden Anlage anschließend auf verschiedene Weisen nachbehandelt wird.