Abgas und Abgasreinigung
Folie 12: CO2
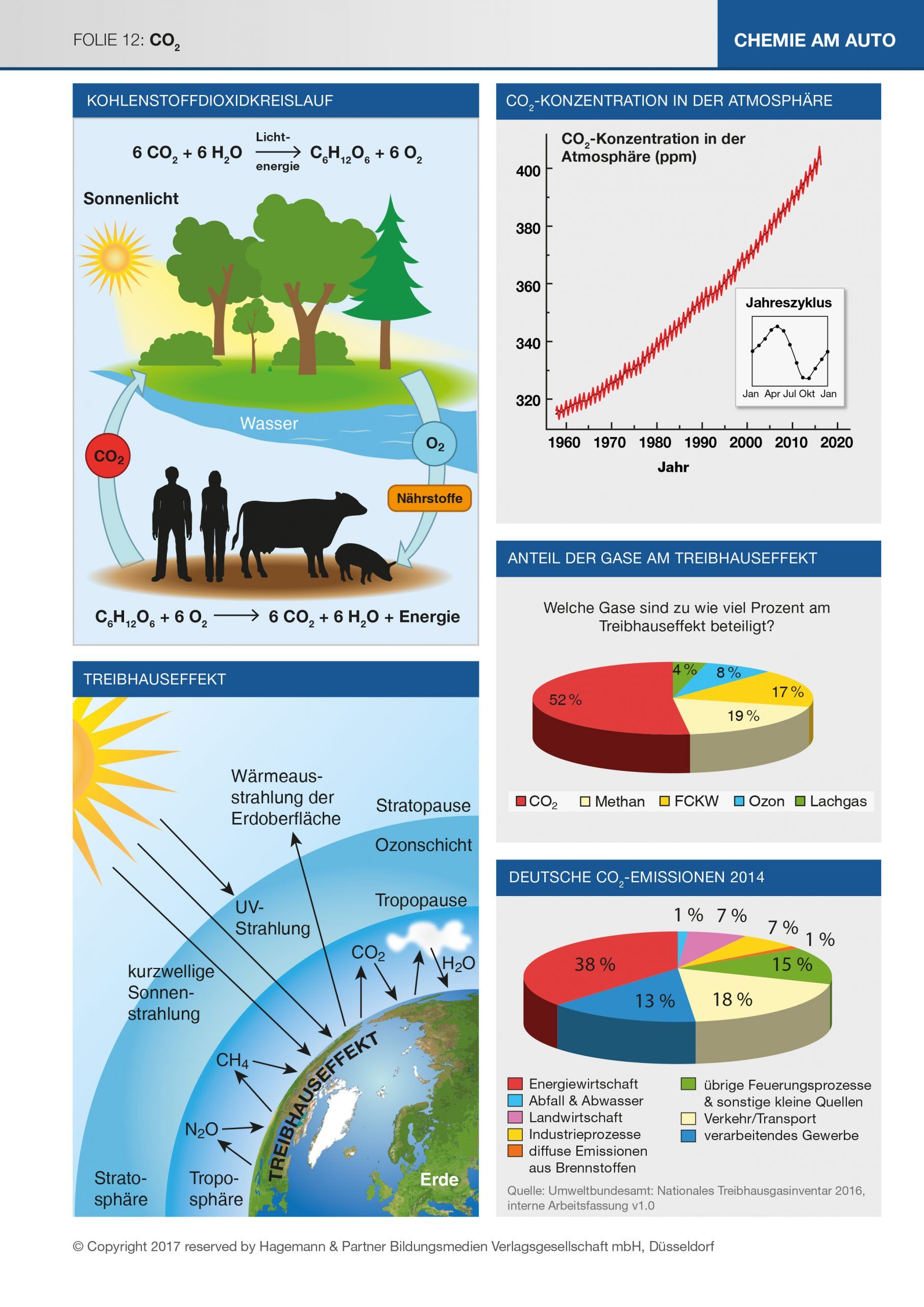
Die Folie zeigt auf der rechten Seite die Entwicklung des CO2-Gehaltes in der Atmosphäre, die Bedeutung für den Treibhauseffekt und die Verursacher des Anstiegs. Die linke Seite zeigt die natürliche Regulation durch den Kohlenstoffdioxidkreislauf sowie die Wirkungen des CO2 und anderer Gase auf die Temperatur an der Erdoberfläche.
Abbildung oben rechts:
Die in Hawaii seit 1958 aufgezeichnete Mauna-Loa-Kurve zeigt einen regelmäßigen Anstieg der CO2-Konzentration in der Erdatmosphäre. („Mauna Loa“ = hawaiianisch „langer Berg“ ist einer der größten aktiven Vulkane der Erde.) Ergänzen sollte man die Darstellung in der Kurve durch die Information, dass bis zum Beginn des 19. Jahrhunderts die CO2-Konzentration der Erdatmosphäre über einen langen Zeitraum ziemlich konstant war. Dies konnte man mithilfe der Untersuchung von Eisbohrkernen nachweisen. Die regelmäßige, jahreszeitliche Schwankung (kleines Bild) rührt daher, dass während der Vegetationsperiode auf der land- und pflanzenreichen Nordhalbkugel der Erde eine verstärkte CO2-Einbindung durch die Photosynthese stattfindet.
Wieso war die CO2-Konzentration lange konstant?
Abbildung oben links:
Das biologische Gleichgewicht zwischen der Kohlenstoffdioxidabgabe bei der Dissimilation der Menschen und Tiere und der Kohlenstoffdioxidaufnahme bei der Photosynthese der Pflanzen führte zu einer etwa gleichbleibenden CO2-Konzentration in der Atmosphäre.
Pflanzen als autotrophe Lebewesen stellen ihre energieliefernden Nährstoffe selbst her. Sie nutzen die Sonnenenergie, um in dem endothermen Photosyntheseprozess aus Wasser und Kohlenstoffdioxid energiereiche Kohlenstoffverbindungen herzustellen, unter Abgabe von Sauerstoff an die Atmosphäre. Besonders in den Nachtstunden gewinnen sie die in den Brennstoffen gespeicherte Energie durch die Oxidation mit Hilfe des Luftsauerstoffs für ihre Stoffwechselvorgänge zurück. Pflanzen stellen jedoch deutlich mehr Kohlenwasserstoffverbindungen her, als sie zu ihrer eigenen Versorgung benötigen. Der Überschuss kommt den heterotrophen Lebewesen, den Menschen und Tieren zugute, die auf fertige, energiereiche Nährstoffe angewiesen sind. Im Prozess der Zellatmung werden die Nährstoffe, wie in der Pflanze selbst, wieder zur Energiegewinnung verbrannt.
Abbildung unten links:
Wir sind heute so daran gewöhnt, Kohlenstoffdioxid als „gefährliches Klimagas“ zu betrachten, dass wir fast vergessen, dass es sich dabei um ein ungiftiges Gas handelt, das nicht nur für den beschriebenen Kreislauf unverzichtbar ist. Man hat errechnet, dass unsere Erdoberfläche ohne Atmosphäre eine sehr ungemütliche Durchschnittstemperatur von –18 °C hätte. Die Erdoberfläche würde die eingestrahlte kurzwellige Sonnenenergie teilweise absorbieren, sich dabei aufheizen und längerwellige Wärmestrahlung abgeben. Das Gleichgewicht von Ein- und Abstrahlung würde sich bei der angegebenen, niedrigen Durchschnittstemperatur einpendeln. Selbst eine Atmosphäre aus Stickstoff und Sauerstoff, den Hauptbestandteilen unserer Luft, würde daran so gut wie nichts ändern, weil diese Gase die kurzwellige Strahlung nicht absorbieren.
Natürlicher Treibhauseffekt
Die tatsächlich 33 °C höhere Durchschnittstemperatur von etwa 15 °C auf der Erde verdanken wir dem natürlichen Treibhauseffekt, der zu etwa 2/3 auf Wasserdampf und zu 1/3 auf andere Gase, überwiegend CO2, zurückzuführen ist. Diese Bestandteile unserer Luft absorbieren ebenfalls Sonnenstrahlung und geben sie als Wärmestrahlung an die Erdoberfläche ab, die sich dadurch erwärmt. Unter diesen Bedingungen ist der Gleichgewichtszustand bei einer höheren Erdtemperatur erreicht und bleibt so lange konstant, wie sich die Zusammensetzung der Atmosphäre nicht ändert.
Künstlicher, anthropogener Treibhauseffekt
Nun ist die CO2-Konzentration der Erdatmosphäre in den letzten zwei Jahrhunderten, besonders aber den letzten Jahrzehnten, von 280 ppmv auf 381 ppmv (parts per million bezogen auf das Volumen) gestiegen (s. Abbildung oben rechts). Damit wird mehr Sonnenlicht absorbiert, die emittierte Wärmestrahlung heizt die Erde weiter auf. Da die CO2-Konzentration weiterhin steigt, ist noch kein neuer Gleichgewichtszustand erreicht, die Jahresdurchschnittstemperaturen steigen weiterhin langsam, aber stetig an.
Die Abbildung Mitte rechts zeigt, welche Gase neben Kohlenstoffdioxid an diesem Vorgang beteiligt sind. Wenn wir heute von Treibhausgasen sprechen, meinen wir in der Regel nur die Gase, deren Konzentration in der Atmosphäre wir Menschen durch unsere Lebensweise in den letzten Jahrhunderten verändert haben und sprechen deshalb vom anthropogenen Treibhauseffekt.
Man sieht, dass Kohlenstoffdioxid mit über 50 % den Hauptanteil am Treibhauseffekt einnimmt. Das liegt jedoch nicht an der besonderen Wirksamkeit von CO2 als Treibhausgas, sondern an seinem mengenmäßigen Vorkommen in der Atmosphäre. Methan ist ein mehr als zwanzig Mal wirksameres Treibhausgas als Kohlenstoffdioxid, kommt aber in viel geringerer Konzentration vor, Lachgas ist sogar etwa 300 mal wirksamer und Fluorchlorkohlenwasserstoffe ca. 14.000 mal. Diese Zahlen geben das Treibhauspotenzial an, d. h. die Erwärmungswirkung einer bestimmten Menge des Gases über einen bestimmten Zeitraum (meist 100 Jahre) im Vergleich zur gleichen Menge CO2.
Wie kommt es zum Anstieg der CO2-Menge in der Atmosphäre?
Die Verbrennung der fossilen Energieträger Kohle, Erdöl und Erdgas führt die seit Jahrmillionen gespeicherten Kohlenstoffmengen als Kohlenstoffdioxid in den Stoffkreislauf zurück. Dieser Prozess begann mit der industriellen Revolution zu Beginn des 19. Jahrhunderts und entspricht auffällig dem Anstieg des Kohlenstoffdioxidgehaltes der Luft.
Die zahlenmäßige Zunahme der gesamten Erdbevölkerung einerseits und die wachsenden Ansprüche des einzelnen Menschen andererseits steigern den Verbrauch ständig, dadurch:
→ wächst die Industrie.
→ steigt der Energieverbrauch der Haushalte.
→ nimmt der Individual- und Güterverkehr zu.
Die Brandrodung des Regenwaldes hat einen doppelten Effekt. Einerseits gehen diese gigantischen Waldflächen als aktive Kohlenstoffspeicher verloren, andererseits wird der bereits in ihnen gespeicherte Kohlenstoff zu CO2 verbrannt und gelangt in die Atmosphäre.
Speicherung von Kohlenstoff
Kohlenstoff wird auf sehr unterschiedliche Weise auf unserer Erde gespeichert und in verschiedene Stoffkreisläufe eingebunden. Hier ein sehr grober Überblick über die gespeicherten Mengen in Gigatonnen (1 Gt = 1.000.000.000 t):
| Gt Kohlenstoff | Speicherort |
| 100.000.000 | im Sediment |
| 40.000 | im Meerwasser |
| 5.000 | in fossilen Energieträgern |
| 1.500 | im Boden (tote Biomasse) |
| 750 | in der Atmosphäre |
| 550 | in lebender Biomasse |
99,95 % des Kohlenstoffs sind also in der Erde im Sediment gespeichert [als Calciumcarbonat = Calcit, CaCO3 oder Calciummagnesiumcarbonat = Dolomit, CaMg[CO3]2. Die Mengen an Kohlenstoffdioxid, die aus diesem Speicher z. B. als Folge von Vulkanausbrüchen zurück in die Atmosphäre gelangen, sind jedoch verschwindend gering.
Der Kohlenstoffgehalt der Atmosphäre in Form von Kohlenstoffdioxid macht fast den geringsten Anteil aus. Dabei darf man aber nicht übersehen, dass bei einem CO2-Gehalt der Luft von nur 0,037 Volumenprozent das Gleichgewicht schon durch absolute Kohlenstoffmengen erheblich gestört werden kann, die uns im Vergleich zum Kohlenstoffgehalt der Erde gering vorkommen. Außerdem belastet CO2 als gasiger Stoff naturgemäß zuerst die Luft.
Ein nicht unerheblicher Teil des Kohlenstoffdioxids wird im Meerwasser gelöst, bzw. reagiert zu Kohlensäure und ihren Dissoziationsprodukten (siehe Kopiervorlage 27, Versuch 1b). Natürlich kann man diesen Versuch auch mit CO2 aus der Druckgasflasche (abgemessen in Kolbenprobern) durchführen, wenn einem der Umweg über die Brausetablette zu weit hergeholt scheint. Andererseits hat man auf diese Weise für Schülerübungen problemlos gleich portionierte Mengen an CO2, wenn man von der im Wesentlichen zutreffenden Annahme ausgeht, dass jede Brausetablette unter gleichen Bedingungen die gleiche Gasmenge produziert.
Die Kohlenstoffbindung des Meerwassers hat sogar mit der steigenden CO2-Belastung der Luft zugenommen, sodass der CO2-Konzentrationsanstieg in der Atmosphäre geringer ist, als bei der vermehrten Emission zu erwarten wäre. Dazu trägt auch die durch die höhere CO2-Konzentration verstärkte Assimilation der Pflanzen bei (erhöhte Photosyntheserate). Dennoch spricht die Mauna-Loa-Kurve eine deutliche Sprache.
Die Abbildung unten rechts zeigt, welchen Anteil die Verursacher der CO2-Emission am Gesamtausstoß haben. Der Anteil, den die Privathaushalte beeinflussen können, ist mit 25 % (Haushalt und PKW) nicht übermäßig groß, aber auch nicht unbedeutend. Mit den persönlichen Möglichkeiten der Einflussnahme sollen sich die Schülerinnen und Schüler in Aufgabe 4 der Kopiervorlage 26 befassen. Dazu sollten sie Recherchen im Internet anstellen, auf Zeitungsartikel achten und sich mit ihren Eltern unterhalten. Die vorgeschlagenen Selbstverpflichtungen lassen sich fast beliebig erweitern.
Analog zu den Berechnungen im Kapitel Kraftstoffe kann man hier den CO2-Ausstoß pro Liter verbrannten Kraftstoffs berechnen. Die Berechnung bezieht sich wieder auf die vollständige Verbrennung von Oktan:
Iso-Oktan + Sauerstoff → Kohlenstoffdioxid + Wasser
C8H18 + 12 ½ O2 → 8 CO2 + 9 H2O
m = 114 g 400 g 352 g 162 g
Die Dichte von Oktan beträgt gerundet 0,7 g/cm3, d. h. 1 Liter Oktan wiegt 700 g. Die Verbrennung von 114 g Oktan erzeugt, wie die obige Reaktionsgleichung zeigt 352 g Kohlenstoffdioxid. Die Verbrennung von 700 g oder 1 l erzeugt dann 2,16 kg CO2.