Kraftstoffe

Brennstoffzelle im Auto
Autos, die keine fossilen Brennstoffe benötigen, sondern Wasserstoff tanken und anstelle von einem Verbrennungsmotor mit einer Brennstoffzelle und einem Elektromotor fahren, sind die Vision für das neue Jahrtausend. Als Prototyp gibt es sie inzwischen schon von den meisten Autofirmen. Aus ihrem Auspuff kommen keine Schadstoffe mehr, sondern lediglich heißer Wasserdampf. Doch wie funktionieren sie?
Das Prinzip der Brennstoffzelle
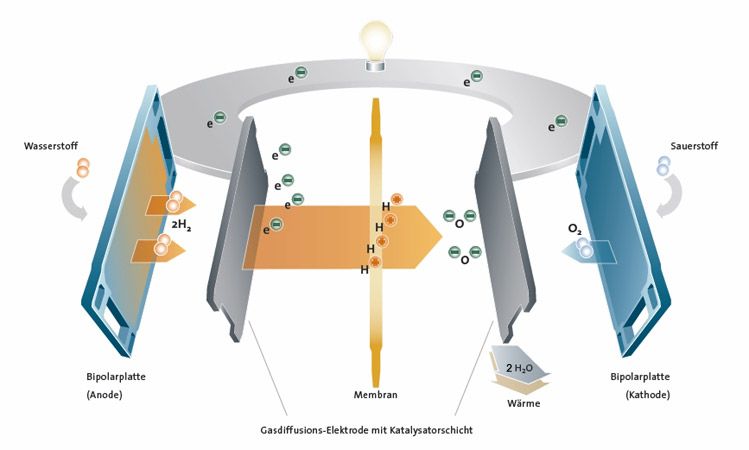
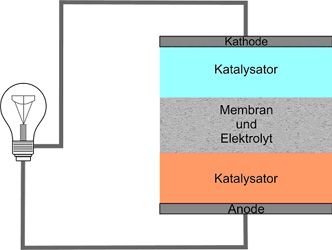
Eine Brennstoffzelle für das Auto ist kaum größer als eine Autobatterie. In ihr reagieren Wasserstoff und Sauerstoff zu Wasser; dabei wird elektrische Energie und Wärme freigesetzt. Üblich im Automobilbau sind Brennstoffzellen, die wie ein Sandwich aufgebaut sind: Eine solche Membrane Electrode Assembly (MEA) = Membran-Elektroden-Einheit, ist etwa 2 mm dick.
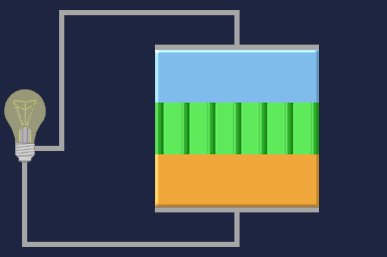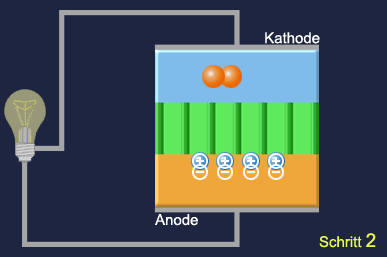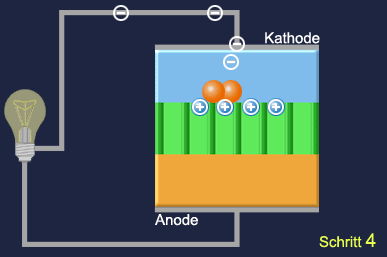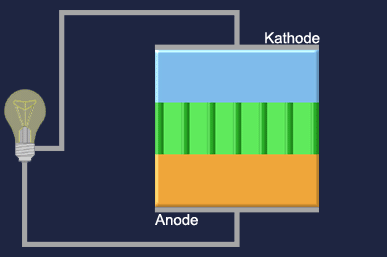
Zwei gasdurchlässige Elektroden sind durch eine Polymerelektrolytmembran (PEM) von etwa 0,1 mm Durchmesser voneinander getrennt, die eine Vermischung der Gase verhindert und protonendurchlässig ist. An die Anodenseite wird Wasserstoffgas zugeführt, an der Kathodenseite Sauerstoff, bzw. Luft, als Elektrolyt dient Wasser. Fein verteiltes Platin in den Elektroden dient jeweils als Katalysator für die Reaktionen.
An der Anode werden Wasserstoffmoleküle mithilfe des Katalysators zuerst in Atome gespalten und diese anschließend jeweils in ein Proton und ein Elektron zerlegt. Nur die Protonen wandern durch die Membran zur Kathodenseite, sodass an der Anode ein Elektronenüberschuss, also ein Überschuss an negativer Ladung entsteht, während sich die Kathode durch die Protonen positiv auflädt. Zwischen Anode und Kathode entsteht so eine elektrische Spannung und wenn man die beiden Elektroden nun außerhalb der Zelle leitend miteinander verbindet, fließt ein Strom. An der Kathode werden die Sauerstoffmoleküle katalytisch in Atome gespalten, die jeweils zwei Elektronen aufnehmen und mit den Wasserstoffprotonen zu Wasser reagieren, das als Wasserdampf entweicht. Außer der gewonnenen elektrischen Energie entsteht also auch noch Wärme.
In dem kleinen Trickfilm wird dieser kontinuierliche Vorgang anschaulich in einzelne Schritte zerlegt:
Brennstoffzelle
Schritt 1: Anode H2 → 2 H (am Katalysator), 2H → 2 H+ + 2 e–
Schritt 2: Die Protonen (H+) wandern durch die Elektrolytmembran
Schritt 3: Die Elektronen (e–) wandern über den äußeren Draht zur Kathode
Schritt 4: Im Draht fließt Strom => die Lampe leuchtet
Schritt 5: Kathode: O2 → 2 O (am Katalysator), 2 O + 4 e– → 2 O2-
Schritt 6: O2- + 2 H+ → H2O
Schritt 7: H2O steigt als Wasserdampf auf
Über 60 % der im Wasserstoff steckenden Energie werden in der Brennstoffzelle in Strom umgewandelt. Die theoretische Spannung für eine solche Wasserstoff-Sauerstoffzelle beträgt 1,23 Volt, praktisch erzielt man etwa 1 Volt pro Zelle. Man fasst daher einige Hundert solcher Zellen zu Stapeln (stacks) zusammen, die dann eine Ausgangsspannung von mehreren 100 Volt liefern. Die elektrische Energie treibt den Elektromotor an und versorgt weitere Systeme, wie Kompressor und Kühlwasserpumpe. Die derzeit eingesetzten Brennstoffzellen sind in der Regel Niedertemperatur-Brennstoffzellen (NT-BZ). Das VW-Versuchsmodell des Jahres 2008 soll beispielsweise mit Brennstoffzellen-Stacks von 100 kW Leistung und mit einem 700 bar Wasserstofftank ausgestattet sein. Außerdem soll eine Rückgewinnung der Bremsenergie technisch realisiert werden.
Die Abgastemperatur beträgt nur etwa 80-90 °C. Der größte Teil der ungenutzten Energie muss also durch erheblich leistungsfähigere Kühlsysteme als im konventionellen Auto abgeführt werden.
Die Aktivität von Katalysatoren steigt mit der Temperatur, beim Niedrigtemperaturbetrieb wird also vergleichsweise viel des teuren Katalysatormaterials (überwiegend Platin) benötigt.
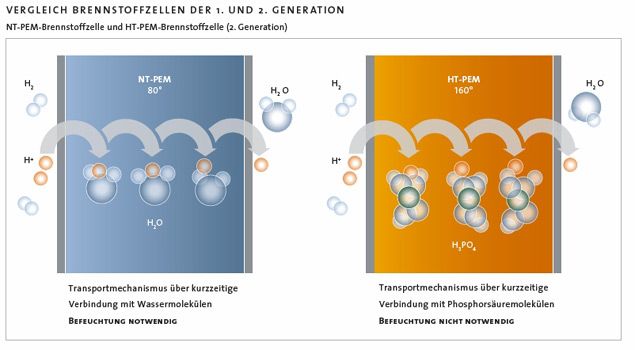
Die Anlagerung von Gasteilchen (Adsorption) an der Katalysatoroberfläche steigt mit abnehmender Temperatur, sodass verstärkt Katalysatorgifte, die als Verunreinigungen im Gasstrom mitgeführt werden, wie Kohlenstoffmonooxid-, Schwefeldioxid- und Schwefelwasserstoffgas, die Leistung der Zellen schwächen. Die Hochtemperatur-Polymerelektrolyt-Brennstoffzelle [HT-PEM-BZ] hat eine Betriebstemperatur bis 180 °C und gilt als Technik der Zukunft: Sie enthält eine Hochtemperaturmembran aus Polybenzimidazol (PBI), die große Mengen Phosphorsäure stabil einlagern kann und statt Wasser als Elektrolyt verwendet wird. PBI ist ein schwarzes Polymer aus aromatischen Monomereinheiten. Es hat einen sehr hohen Schmelzpunkt und ist fest, hart und druckbeständig. PBI wurde 1983 für das Raumfahrtprogramm der NASA entwickelt und schon kurz nach der Markteinführung als Oberstoff von Feuerwehranzügen und für Schutzhauben verwendet.
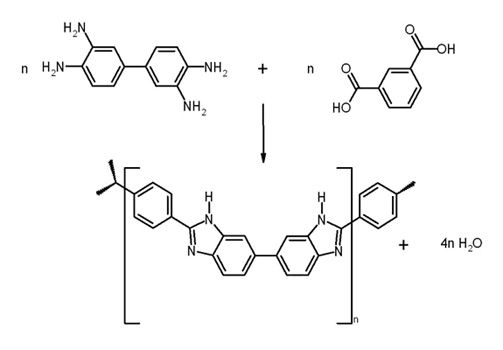
Bei diesem Brennstoffzellen-Typ ist keine Gasbefeuchtung nötig (Platz -und Kostenersparnis), aber es entsteht wie bei der NT-PEM-BZ an der Kathode Produktwasser. Dieses kann die Elektroden dauerhaft schädigen. Dieses Problem wurde inzwischen durch einen neuen Elektrodentyp gelöst.
Geringere Empfindlichkeit gegen Luftverschmutzung.
Einfachere Kühlung, weil die Differenz zwischen der Außentemperatur und der mittleren Arbeitstemperatur von 160 °C höher ist.
Voraussetzung für einen BZ-Antrieb ist jedoch immer eine Wasserstoffgewinnung, die allen Ansprüchen der heutigen umweltschonenden Energieerzeugung genügt. Ideal wäre Erzeugung von Wasserstoff durch Solarenergie, sobald diese eine ausreichend positive Energiebilanz aufweisen kann. Eine solche Anlage lässt sich in der Schule sehr schön an den diversen im Handel erhältlichen Brennstoffzellen-Modellautos darstellen [s. Abbildung]. Die links sichtbare Solarzelle erzeugt die Energie zur Spaltung des Wassers im Tank auf der rechten Seite. Die Gase Wasserstoff und Sauerstoff werden in den beiden Gastanks im Wasser gesammelt, wobei der Wasserstofftank natürlich doppelt so groß ist wie der Sauerstofftank. (Da die Beleuchtung der Solarzelle mit Sonnenlicht sich im Unterricht meist als zu langsam erweist, hilft das im Umlenkspiegel reflektierte Licht des Tageslichtprojektors oder eine ähnlich starke Lichtquelle, das Prinzip im überschaubareren Zeitrahmen zu demonstrieren.) Sind die Gastanks gefüllt, werden die Gase in die Brennstoffzelle geleitet, der Motor wird angetrieben. Die Gastanks leeren sich unter Rückbildung von Wasser.
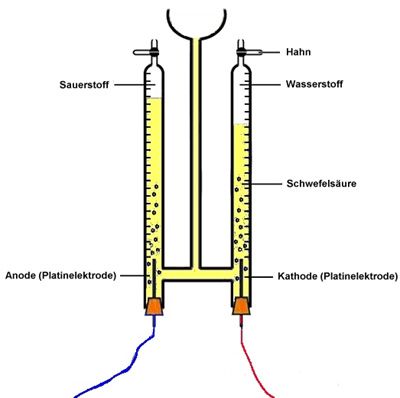
Die Elektrolyse des Wassers entspricht den Vorgängen im Hoffmannschen Wasserzersetzungsapparat.
Kathodenreaktion:
4 H3O+ + 4e– → 2H2 + 4 H2O
Anodenreaktion:
6 H2O → 4 H3O+ + O2 + 4 e–
Gesamtreaktion:
2 H2O → 2 H2 + O2